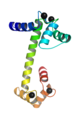
Proteiinin rakenne

Proteiinien rakenne on kolmiulotteinen. Aminohapot, joista proteiinit vähintään koostuvat, ovat niissä yhdistyneet peptidisidoksin pitkiksi polymeeriketjuiksi eli polypeptideiksi. Ketjut järjestäytyvät kullekin proteiinille ominaiseen kolmiulotteiseen muotoon.[1] Järjestymistä sanotaan laskostumiseksi ja lopullista muotoa proteiinin natiiviksi rakenteeksi. Laskostuminen eliöissä tapahtuu itsenäisesti, mutta sitä voivat joskus avustaa eri chaperoniini-proteiinit, joiden päätehtävä on estää proteiineiksi vielä kehittymättömien peptidiketjujen sakkautumista yhteen eli aggregraatiota.[2] Natiivin rakenteen hajoamisessa proteiini menettää toimintonsa. Tätä sanotaan denaturaatioksi, joka tapahtuu vaikkapa korkeissa lämpötiloissa tai hyvin happamissa tai emäksissä oloissa.[3]
Kaikkia proteiinirakenteita voidaan käsitellä 4:llä käsitteellisellä tasolla. Alin taso eli primäärirakenne on pepidiketjun aminohappojen järjestys ja muiden kovalenttisidosten sijainti peptidiketjussa.[4][5] Sekundäärirakenne on peptidiketjun lyhyiden pätkien järjestyminen kolmiulotteisiin muotoihin, kuten α-kierteiksi ja β-levyiksi.[6][7] Tertiäärirakenne koko proteiinin kolmiulotteinen rakenne, joka koostuu polypeptidiketjusta ja muista siihen kovalenttisesti liittyneistä molekyyleistä – se on pienien proteiinien ylin rakennetaso.[8][7] Jotkin yksittäisistä peptidiketjuista koostuvat proteiinit voivat liittyä toisiinsa tuottaen useiden peptidiketjujen proteiiniryhmiä – kahdesta tai useasta peptidiketjusta koostuvalla proteiinilla on kvaternäärirakenne.[9][10]
Kolmiulotteisen muotonsa perusteella proteiineja voidaan luokitella lisäksi karkeasti globulaarisiin eli pallomaisiin ja kuitumaisiin proteiineihin, joista esimerkkejä ovat vastaavasti hemoglobiinit ja kollageenit.[11] Tarkempia rakenneluokittelussa käytettyjä käsitteitä ovat useista sekundäärirakenteista koostuvat motiivit ja domeenit.[12]
Tietyt proteiinit muovautuvat eri tavoin translaation jälkeen eli post-translationaalisesti. Translaatiossa syntyneet peptidiketjut alkavat aitotumaisilla metioniinilla (syy tähän on geneettinen koodi) ja monilla bakteereilla N-formyylimetioniinilla, jotka usein poistuvat translaation jälkeen. Aminohappojen välille voi myös muodostua vaikkapa disulfidisidoksia; aminohapot voivat fosforyloitua (esim. kaseiinit), karboksyloitua (esim. protrombiini) tai muuntua muulla tavoin; niihin voi liittyä prosteettisia ryhmiä, kuten biotiini (esim. asetyyli-CoA-karboksylaasi) tai hemi (esim. hemoglobiinit); niihin voi liittyä isoprenyyleitä, hiilihydraatteja tai muita molekyylejä.[13] Näiden perusteella proteiinirakenteita voidaan luokitella esimerkiksi sokereita sitoviin glykoproteiineihin; lipidejä sitoviin lipoproteiineihin ja nukleiinihappoja sitoviin nukleoproteiineihin.[11]
Röntgenkristallografia on tyypillinen proteiinirakenteen selvittämiseen käytetty menetelmä. Muita vähemmän käytettyjä menetelmiä ovat muun muassa NMR-spektroskopia ja kryoelektronimikroskopia.[14]
Peptidit ovat lyhyitä proteiineja.
Primäärirakenne
[muokkaa | muokkaa wikitekstiä]Proteiinit koostuvat vähintään aminohapoista. Aminohapot ovat toisissaan perättäin kiinni peptidisidoksin tuottaen ketjun eli peptidiketjun. Proteiineissa on usein enintään 20 erilaista aminohappoa, mutta joissain proteiineissa on harvinaisempiakin aminohappoja.[1]
Esitystapaa aminohappojen järjestyksestä ketjussa sanotaan aminohapposekvenssiksi. Järjestystä ja muita ketjussa mahdollisesti olevia aminohappojen välisiä sidoksia sanotaan primäärirakenteeksi.[5] Näitä muita proteiineissa yleisiä sidoksia ovat kysteiinien disulfidisidokset. Primäärirakenne kuvaa siis proteiinin kovalenttisidoksia, muttei proteiinin kolmiulotteista rakennetta.[4]

Ketjun aminohappoja sanotaan aminohappotähteiksi (eng. residue), sillä ne eivät ole peptidisidoksen muodostumisen jälkeen enää kokonaisia aminohappoja. Useimmissa eliöiden kudoksissa vallitsee pH-arvo, joka on noin 7. Poolisen sivuketjun omaavat aminohapot ovat näissä oloissa ionisoituneet, jonka takia tähteistä puhutaan joskus niiden ionimuotojen nimillä. Esimerkiksi glutamiinihappotähteen sijaan saatetaan puhua glutamaattitähteestä.[1]
Peptidiketjun toisessa päässä on vapaana aminoryhmä (NH3). Tätä sanotaan N-terminaaliksi. Toisessa päässä on vapaana karboksyylihapporyhmä (COOH) eli C-terminaali. Yleisen käytännön mukaan kirjoitetussa muodossa sekvenssit ja primäärirakenteet esitetään vasemmalta N-terminaalista lukien oikealle C-terminaaliin. Sekvenssin aminohapot esitetään usein aminohapoista käytetyin kirjainsymbolein. Esimerkiksi Met-Val-Phe eli MVF on peptidi (lyhyt "proteiini"), jossa metioniinitähde (Met, M) omaa vapaan aminoryhmän, valiinitähde (Val, V) on keskellä ja fenyylialaniinitähde (Phe, F) omaa vapaan karboksyylihapporyhmän.[1]
Sekundäärirakenne
[muokkaa | muokkaa wikitekstiä]Peptidiketjuissa aminohappotähteillä, paitsi glysiinillä, on sivuketju.[1] Jätettäessä sivuketjujen kolmiulotteiset järjestäytymiset eli konformaatiot huomiotta, voidaan puhua peptidirungon konformaatiosta.[15]
Rungon sidokset voivat kiertyä, jolloin runko tuottaa verrattain vakaita kolmiulotteisia rakenteita, joita löytyy periaatteessa kaikista proteiineista. Näitä sanotaan sekundäärirakenteiksi. Esimerkkejä proteiineissa erittäin yleisistä sekundäärirakenteista ovat α-kierteet ja β-levyt.[15][6] Näitä kierteitä ja levyjä esitetään yleensä vastaavasti kolmiulotteisin kiertein ja nuolin proteiinien kolmiulotteisissa rakennekaavoissa. Kokonaisen proteiinin peptidiketjusta eristettynä jonkin sekundäärirakenteen muodostava peptidipätkä ei silti usein pysty tuottamaan vakaata rakennetta, vaan kiertyilee liuoksissa likimain satunnaisesti.[16]

Sekundäärirakenteiden lisäksi proteiineissa on niitä toisiinsa yhdistäviä kierroksia tai silmukoita (eng. turns, loops). Nämä ovat usein lyhyitä – niissä on vain muutama aminohappo, eikä niillä ole välttämättä tiettyä kolmiulotteista muotoa. Kuitenkin esimerkiksi β-levyistä koostuvissa hiusneularakenteissa on tunnistettavissa kierroksia, jotka toistuvat eri proteiineissa.[16]
Kiertokulmat
[muokkaa | muokkaa wikitekstiä]Rungon aminohapon sivuketjua sitovaa hiiltä sanotaan alfahiileksi Cα. Peptidisidoksen karbonyylihiilen lyhenne on C ja typen N. Sidokset voivat kiertyä ja kierto-, dihedraali- eli torsiokulmille on symbolit:[16]
C–N väliset peptidisidokset omaavat kaksoissidosluonnetta resonanssin takia. Siten ne eivät kierry helposti, sillä tämä edellyttää kaksoissidoksen rikkoutumista. Siksi ne ilmentävät cis-trans-isomeriaa. Kukin ω kiertokulma voi siis olla noin 0° (cis) tai 180° (trans). cis-sidokset ovat proteiineissa harvinaisia, sillä niissä sivuketjut ovat lähellä toisiaan vieden toisiltaan tilaa. Ne tuottavat toisilleen steerisen esteen ollen siis energiallisesti epäedullisia. Poikkeuksena kuitenkin eritoten 2 perättäistä proliinia voivat sivuketjun rakenteensa takia tuottaa verrattain edullisia cis-sidoksia.[16]

Kulmat φ ja ψ voivat olla välillä -180–180°. Aste on 0°, jos rungon atomit ovat kohdakkain. Kulma on positiivinen, jos se kiertyy oikean käden säännön mukaiseen suuntaan, ja negatiivinen jos päinvastaiseen suuntaan (kuva). φ ja ψ kiertyminen on sivuketjujen takia kuitenkin rajoittunutta. Mahdolliset kulmat riippuvat sekundäärirakenteesta ja jonkin proteiinin kaikkia mahdollisia rungon kiertokulmia voidaan esittää Ramachandran-kuvaajassa, jollaisesta ilmenee hyvin myös mahdollisten kiertokulmien riippuvuus sekundäärirakenteesta.[16]
-
Resonanssi. Kuvassa näkyy myös Cα:n, C:n ja N:n sijainti.
-
trans- (vasen) ja cis-peptidisidos. R ovat joitakin sivuryhmiä.
Tertiäärinen rakenne
[muokkaa | muokkaa wikitekstiä]Tertiäärinen rakenne tarkoittaa yhdestä peptidiketjusta koostuvan proteiinin kolmiulotteista rakennetta kokonaisuudessaan.[8] Se koostuu sekundäärirakenteista. Joissain proteiineissa on tosin vielä alemmassa kappaleessa käsitelty kvaternäärirakenne.[7] Tertiäärirakenteessa voi olla myös translaation jälkeen liittyneitä molekyylejä.[13] Proteiinien pinnassa on myös sen ympäristöstä tulleita vetysidoksin kiinni olevia vesimolekyylejä, ns. hydraatteeina, joiden sijainnit samanlaisten proteiinien välillä ovat likimain samat, jonka takia niiden ominaisuudet poikkeavat vapaana olevista vesistä.[17] Pinnan vedet ovat usein tärkeitä proteiinien rakenteen ja toiminnan kannalta ollen siis erottamaton osa niiden ominaisuuksia,[18] vaikkei niitä luetakaan tertiäärirakenteeseen.
Tertiäärirakenteen muodostumista sanotaan laskostumiseksi. Laskostuminen tapahtuu kohti vakainta eli pienimmän energian omaavaa rakennetta.[19] Vesiliuoksissa rakenteen rasvaliukoisen sivuketjun omaavat aminohapot pyrkivät proteiinin sisälle ja vesiliukoisen sivuketjun omaavat ulkopinnalle kosketuksiin vesimolekyylien kanssa. Tämä ns. hydrofobinen vaikutus on pääasiallinen proteiinien laskostumista ohjaava vaikutus. Vähemmässä määrin tiettyyn muotoon laskostumista ajavia vaikutuksia ovat van der Waalsin voimat ja ioniset vuorovaikutukset muun muassa positiivisesti ja negatiivisesti varautuneiden ionisoituneiden aminohappotähteiden sivuketjujen välillä. Vahvat vetysidokset osallistuvat myös laskostumiseen. Niitä on proteiinissa paljon, mutta niiden vaikutus laskostumisessa ei usein ole erityisen merkittävää, sillä laskostumisessa vetysidokset vesimolekyylien ja proteiinin välillä rikkoutuvat ja korvautuvat proteiinin sisäisillä sidoksilla. Rikkoutuvat ja muodostuvat vetysidokset siis kumoavat toisiaan.[16]
Kvaternäärinen rakenne
[muokkaa | muokkaa wikitekstiä]- Pääartikkeli: Proteiinien kvaternäärirakenne
Jotkin proteiinit koostuvat useista erillisistä proteiineiksi muotoutuneista peptidiketjuista eli proteiiniyksiköistä. Useiden yksiköiden kokonaisuutta sanotaan kvaternäärirakenteeksi. Yksiköt voivat olla toisissaan kiinni ei-kovalenttisesti tai kovalenttisesti esimerkiksi disulfidisidoksin. Vain yhden proteiiniyksikön omaavilla proteiineilla ei ole kvaternäärirakennetta.[9] Esimerkiksi hemoglobiini A koostuu 4:stä erillisestä proteiinista, jotka tuottavat sille kvaternäärirakenteen. Myoglobiinissa taas on 1 yksikkö, eli sillä ei ole kvaternäärirakennetta.[7] Kvaternäärirakenne voi olla keskeinen proteiinin toiminnan kannalta, eivätkä tällaisen proteiinin yksittäiset yksiköt toimi kunnolla erikseen.[20]
Motiivit
[muokkaa | muokkaa wikitekstiä]Kaksi tai useampi sekundäärirakenne voi tuottaa yhdistelmän, jota sanotaan motiiviksi. Niitä on monia ja ne toistuvat eri proteiineissa kyllin usein, jolloin ne voidaan luokitella motiiveiksi. Motiivilla voi olla jokin biologinen toiminto, muttei aina. Motiivit voivat myös koostua erillisistä proteiineista.[12]
Esimerkkejä motiiveista ovat (motiivien suomenkielisistä käännöksistä osa on vakiintumattomia nimiä)
- kierre-käännös-kierre (eng. helix-turn-helix). Nämä koostuvat 2:sta α-kierteestä, joita yhdistää lyhyt käännös. Nämä rakenteet ovat yleisiä tiettyjä DNA-sekvenssejä tunnistavissa proteiineissa. Kierteiden vaihtelevat aminohapot sitoutuvat välillisesti, mutta vahvasti vain tietyn järjestyksen omaaviin nukleiinihappoihin DNA:ssa, joka mahdollistaa tunnistuksen.[12]
- kierre-silmukka-kierre (eng. helix-loop-helix). Nämä koostuvat 2:sta α-kierteestä, joita yhdistää verrattain pitkä silmukaksi kiertynyt peptidipätkä. Silmukkaan voi sitoutua ioneita, kuten kalsiumia (Ca2+). Motiivi on yleinen kalsiumia sitovissa proteiineissa, kuten kalmoduliinissa.[12]
- kreikkalainen avain (eng. greek key). Nämä koostuvat 4:stä β-levystä. Niillä ei ole tiettyä toimintoa. Ne muistuttavat kreikkalaisen taiteen meanderi-koristekuviota, josta nimi juontuu.[12]
- β-α-β-motiivi. Nämä koostuvat α-kierteestä ja 2:sta β-levystä. Näitä on lähes kaikissa proteiineissa. Esimerkiksi trioosifosfaatti-isomeraasissa on vain β-α-β-motiiveita,[12] jotka tuottavat yhdessä isomman kokonaisuuden, α/β-tynnyridomeenin (katso kohta domeeni).
- kiertyneet kierteet eli superkierteet. Nämä koostuvat usein pitkistä α-kierteistä, jotka ovat sama- tai vastakkaissuuntaisia. Nämä kiertyvät toistensa ympärille. Lyhyet kierteet edistävät suurempien proteiinikokonaisuuksien muodostumista. Esimerkiksi c-Fos ja c-Jun ovat erillisiä α-kierreproteiineja. Ne tuottavat superkierteen, joka toimii transkriptiotekijänä tunnistaen ja sitoutuen tiettyihin DNA-sekvensseihin. Pitkät superkierteet taas ovat yleensä osa rakenneproteiineja.[12] Esimerkiksi rakenneproteiineihin lukeutuva α-keratiini koostuu 2:sta vasenkätisestä α-kierteestä (katso aksiaalinen kiraalisuus). Kollageenit taas koostuvat 3:sta vasenkätisestä kierteestä, jotka eivät siis ole α-kierteitä. Kierteet kiertyvät kolmoissuperkierteeksi.[9]
- kääretorttumotiivi (eng. jelly roll motif). Nämä koostuvat 8:sta perättäisestä β-levystä, jotka kertyvät eri tavoin sylinterimäiseksi rakenteeksi.[21]
- vyötiäismotiivi (eng. armadillo motif). Nämä koostuvat 2:sta α-kierteestä, jotka ovat kierre-käännös-kierre -motiivin kaltaisia. Kierteet ovat ristikkäin. 2:n kierteen yksiköt voivat toistua perättäin tuottaen hyvin pitkiä ketjuja.[21]
-
Useita kierre-silmukka-kierteitä kalmoduliinissa (pallot ovat kalsiumioneita)
-
Kreikkalainen avain
-
Kiertynyt kierre, joka koostuu c-Jun- ja c-Fos-proteiineista, jotka ovat sitoutuneena DNA:han
-
Kääretorttumotiivi tupakan mosaiikkivruksen kapsidista
-
Vyötiäismotiivi β-kateniinissa
Domeenit
[muokkaa | muokkaa wikitekstiä]Yksi tai useampi motiivi voivat tuottaa domeenin.[12] Sitä voidaan pitää proteiinin osana, joka muodostaa selkeärajaisen rakenteen proteiinissa. Domeeni voi esimerkiksi liikkua kokonaisuutena muusta proteiinista riippumattomasti kolmiulotteista rakennettaan menettämättä tai olla itsessään vakaa irrotettaessa domeeni muusta proteiinista. Pienissä proteiineissa domeeneita on vain yksi. Domeeneilla voi joskus olla myös jokin tietty toiminto – ne voivat vaikkapa vuorovaikuttaa toisten proteiinien kanssa tai sitoa pieniä molekyylejä.[3] Jonkin entsyymin domeeneista voi esimerkiksi olla aktiivinen kohta, mutta ne voivat olla myös kahden domeenin välissä.[21] Domeeneissa on selkeä hydrofobinen ydin ja ne voivat kehittyä proteiinien evoluution myötä itsenäisesti ja eri domeenien yhdistelmät voivat tuottaa uusia proteiineja. Tyypillisesti domeenissa on 50–100 aminohappoa.[7]
Esimerkkejä domeeneista ovat
- α/β-tynnyrit. Nämä ovat yleisiä entsyymeissä ja muodostavat β-α-β-motiiveista pyöreän tynnyrimäisen rakenteen. Tynnyrin omaavissa entsyymeissä sen keskiössä on yleensä aktiivinen kohta, kuten trioosifosfaatti-isomeraasissa. Jotkin ei-entsymaattiset kuljetinproteiinit taas kuljettavat tynnyrin sisässä eri aineita eri puolille eliötä.[21]
- β-tynnyrit. Nämä muodostavat vastakkaissuuntaisista β-levyistä tynnyrimäisen rakenteen. Levyjä on usein noin 4–10. Niitä on kuljetinproteiineissa, entsyymeissä, kalvoproteiineissa ja viruksissa. Esimerkiksi ihmisen superoksididismutaasi 1:ssä ja kuljetinproteiineihin lukeutuvissa retinolia sitovissa proteiineissa, kuten RBP4:ssä, on β-tynnyri. RBP4:ssä rasvaliukoinen retinoli kulkee rasvaliukoisia aminohappoja sisältävän tynnyrin sisässä vesiliukoisessa ympäristössä.[21]
- β-propellerit. Näissä kreikkalaiset avain -motiivit tuottavat potkuria muistuttavan kehämäisen rakenteen, jossa avaimet ovat potkurin "lapoja". Avainten määrät vaihtelevat. Esimerkiksi neuraminidaasissa on β-propelleri, jossa on 6 avainta, joiden keskiössä tämän entsyymin aktiivinen kohta.[21]
-
α/β-tynnyri trioosifosfaatti-isomeraasissa
-
β-tynnyri RBP1:ssä (tynnyrin sisällä on retinoli)
-
β-propelleri KEAP1:ssä
Lähteet
[muokkaa | muokkaa wikitekstiä]- J Kuriyan et al: The molecules of life: physical and chemical principles. Garland science, 2013. ISBN 9780815341888
- DL Nelson et al: Lehninger principles of biochemistry. W.H. Freeman, 2008. ISBN 9780716771081
- JL Jain, S Jain, N Jain: Fundamentals of biochemistry. (6. painos) S. Chand & Co., Ltd, 2005. ISBN 9788121924535
Viitteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e Kuriyan, s. 25–29
- ↑ Kuriyan, s. 191–192
- ↑ a b Nelson, s. 135–140
- ↑ a b Nelson, s. 92
- ↑ a b IUPAC - primary structure (P04843) goldbook.iupac.org. Viitattu 12.10.2019.
- ↑ a b IUPAC - secondary structure (S05530) goldbook.iupac.org. Viitattu 12.10.2019.
- ↑ a b c d e Kuriyan, s. 131–132
- ↑ a b IUPAC - tertiary structure (T06282) goldbook.iupac.org. Viitattu 14.10.2019.
- ↑ a b c Nelson, s. 123–125
- ↑ IUPAC - quaternary structure (Q05004) goldbook.iupac.org. Viitattu 14.10.2019.
- ↑ a b Jain, s. 205–209
- ↑ a b c d e f g h Kuriyan, s. 150–154
- ↑ a b Jain, s. 749–752
- ↑ SC Shoemaker, N Ando: X-rays in the cryo-EM era: structural biology’s dynamic future. Biochemistry, 2018, 57. vsk, nro 3, s. 277–285. PubMed:29227642 doi:10.1021/acs.biochem.7b01031 ISSN 0006-2960 Artikkelin verkkoversio.
- ↑ a b Nelson, s. 117
- ↑ a b c d e f g Kuriyan, s. 134–148
- ↑ Kuriyan, s. 601–602
- ↑ SH Chong, S Ham: Dynamics of hydration water plays a key role in determining the binding thermodynamics of protein complexes. Scientific Reports, 2017, 7. vsk, nro 1, s. 1–10. doi:10.1038/s41598-017-09466-w ISSN 2045-2322 Artikkelin verkkoversio.
- ↑ Kuriyan, s. 840
- ↑ Nelson, s. 648–649
- ↑ a b c d e f Kuriyan, s. 160–166
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- CATH - proteiinien evoluutioon perustuva tietokanta (englanniksi)
- SCOP - proteiinien rakenteeseen perustuva tietokanta (Arkistoitu – Internet Archive) (englanniksi)
- RCSB PDB - proteiinien rakenteita (englanniksi)
- AlphaFold Protein Structure Database (englanniksi)